Investigación de la FDA sobre quejas por Cronobacter: Fórmula infantil en polvo (febrero de 2022)
No use las fórmulas en polvo para bebés de Similac, Alimentum o EleCare retiradas del mercado y producidas en la instalación de Abbott Nutrition en Sturgis, MI
Si desea verificar si su fórmula en polvo es parte del retiro, puede ingresar el código de lote del producto en la parte inferior de su paquete en el sitio web de la compañía.
Si tiene preguntas o necesita información sobre el retiro, puede Enviar preguntas/Obtener asistencia.
Si su bebé experimenta síntomas relacionados con la infección por Cronobacter, como falta de apetito, irritabilidad, cambios de temperatura, ictericia, respiración entrecortada o movimientos anormales; comuníquese con su proveedor de atención médica para reportar sus síntomas y recibir atención inmediata.
Para reportar una enfermedad o evento adverso, puede
-
Llame a un Coordinador de Quejas del Consumidor de la FDA si desea hablar directamente con una persona sobre su problema.
-
Llene el formulario electrónico voluntario de MedWatch en línea.
-
Llene el formulario voluntario de MedWatch en papel que se puede enviar por correo a la FDA.
La FDA, junto con los CDC y los socios estatales y locales están investigando las quejas de los consumidores y/o los reportes de enfermedades infantiles relacionadas con los productos de la instalación de Abbott Nutrition en Sturgis, MI. Se ha reportado que todos los pacientes enfermos han consumido fórmula infantil en polvo producida en la instalación de Abbott Nutrition en Sturgis, MI.
Para aclarar qué productos se incluyen en el retiro de Abbott Nutrition, la FDA publica una lista completa de las marcas retiradas que se incluyeron en el retiro inicial y ampliado. Los productos retirados ya no deberían estar disponibles para la venta, pero si los consumidores tienen estos productos en sus hogares, deben verificar el código de lote en la parte inferior del paquete para determinar si está incluidos en el retiro.
La FDA también proporciona información adicional para los padres y cuidadores de bebés que reciben fórmulas médicas especiales para bebés y para las personas que usan ciertos alimentos médicos.
Entendemos que la fórmula infantil es la única fuente de nutrición para muchos bebés y es un producto esencial. La FDA está trabajando con Abbott Nutrition para evaluar mejor el impacto del retiro del mercado y comprender la capacidad de producción en otras instalaciones de Abbott que producen algunas de las marcas afectadas. También estamos trabajando con Abbott Nutrition en la reanudación segura de la producción en la instalación en Sturgis, MI. La FDA sigue investigando y actualizará este aviso si se dispone de información adicional sobre la seguridad del consumidor.
Recomendación
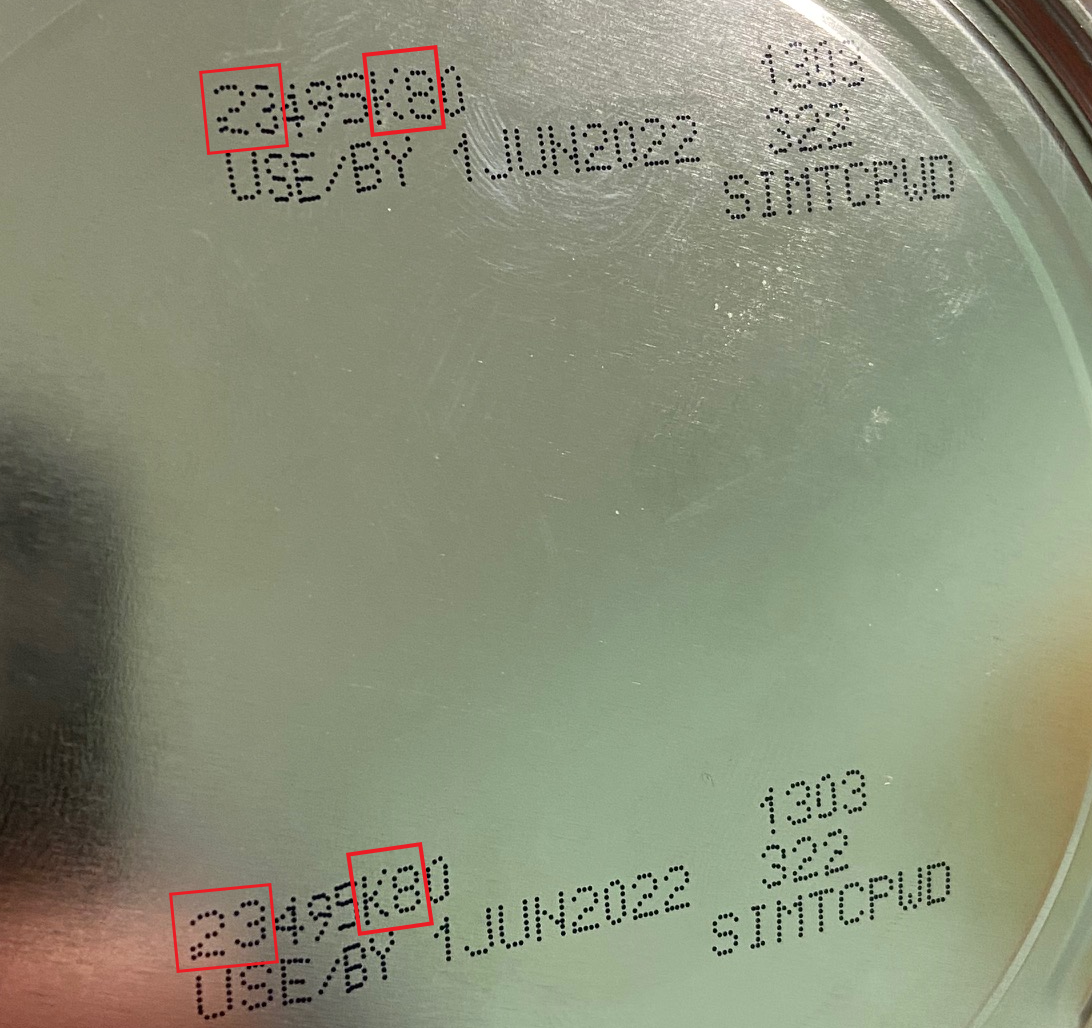
La FDA aconseja a los consumidores que no usen las fórmulas infantiles en polvo de Similac, Alimentum o EleCare retiradas del mercado. Los productos retirados pueden identificarse por el código de 7 a 9 dígitos y la fecha de vencimiento que aparecen en la parte inferior del envase (véase la siguiente imagen). Los productos están incluidos en el retiro del mercado si tienen los tres elementos indicados a continuación:
- los dos primeros dígitos del código son del 22 al 37; y
- el código del envase contiene K8, SH o Z2; y
- la fecha de vencimiento es el 4-1-2022 (APR 2022) o posterior.
Además de los productos descritos anteriormente, Abbott Nutrition ha retirado Similac PM 60/40 con el código de lote 27032K80 (lata) / 27032K800 (caja). En este momento, Similac PM 60/40 con el código de lote 27032K80 (lata) / 27032K800 (caja) son los únicos tipos y lotes de esta fórmula especial que se están retirando.
Puede encontrar información adicional sobre el retiro inicial (en inglés) en el sitio web de la FDA. Los padres también pueden ingresar el código de lote de su producto en el sitio web de la compañía para verificar si su producto forma parte del retiro del mercado.
A continuación, se encuentra disponible información adicional para padres y cuidadores de bebés que reciben fórmulas médicas especiales para bebés y personas que usan ciertos alimentos médicos.
Información adicional para los padres y cuidadores:
Los retiros no incluyen productos de fórmula líquida. Los consumidores deben seguir utilizando todos los productos no incluidos en los retiros.
Los padres y cuidadores nunca deben diluir las fórmulas infantiles y no deben preparar ni dar a los bebés fórmulas caseras (en inglés). Los consumidores también deben evitar la compra de fórmulas importadas a través de ventas en línea, ya que pueden ser falsificadas (en inglés).
Si su fórmula habitual no está disponible, póngase en contacto con el proveedor de atención médica de su hijo para que le recomiende un cambio en sus prácticas de alimentación.
Si usted obtiene la fórmula infantil a través de WIC (en inglés), no tire la fórmula. Llévela a la tienda para obtener un reembolso y cambiarla, o llame a la compañía al 1-800-986-8540 para que le ayuden. Los beneficiarios de WIC deberían poder obtener una marca diferente de fórmula similar. Llame a su clínica local de WIC para obtener más orientación. Consulte también:
- Seguridad de las fórmulas infantiles del USDA FNS (WIC) (en inglés)
- Números gratuitos de las agencias estatales de WIC
- Mapa de contactos del USDA (en inglés)
Hay más información sobre Cronobacter y las fórmulas infantiles en el sitio web de los CDC.
Las fórmulas infantiles en polvo retiradas del mercado pueden estar contaminadas con Cronobacter, una bacteria que puede causar enfermedades alimentarias graves, principalmente en los bebés. Las infecciones por Cronobacter son raras, pero tienen un riesgo especialmente alto para los recién nacidos (vea los síntomas más abajo).
La bacteria Cronobacter puede causar infecciones graves y potencialmente mortales (sepsis) o meningitis (una inflamación de las membranas que protegen el cerebro y la columna vertebral). Los síntomas de la sepsis y la meningitis pueden incluir una alimentación deficiente, irritabilidad, cambios de temperatura, ictericia (piel y blanco de los ojos amarillos), respiración con gruñidos y movimientos anormales. La infección por Cronobacter también puede causar daños intestinales y puede extenderse a través de la sangre a otras partes del cuerpo.
Si su hijo presenta alguno de estos síntomas, debe notificar al proveedor de atención médica de su hijo y buscar atención médica para su hijo inmediatamente. Se insta a los proveedores de atención médica y a los departamentos de salud a que informen a los CDC de cualquier caso confirmado de Cronobacter sakazakii.
Imágenes del producto
Número de casos
Número de eventos adversos: 4
Hospitalizaciones: 4
Muertes reportadas: 2*
Fechas de los eventos adversos: 9/6/2021 – 1/4/2022
Estados con eventos adversos: MN (1), OH (2), TX (1)
Distribución del producto: A nivel nacional e internacional
* Se han notificado dos muertes. La infección por Cronobacter puede haber contribuido a la causa de la muerte de ambos pacientes enfermos.
Enlaces útiles
- Anuncio de retiro del mercado en los EE. UU. (en inglés)
- Retiro Aviso de retiro: EE. UU./Puerto Rico
- Advertencia de retiro del mercado en Canadá (en inglés)
- Sitio de retiro del mercado de Abbott Nutrition
- La infección por Cronobacter y los bebés
- La infección por Cronobacter y los bebés (en inglés)
- Consejos de seguridad alimentaria para consumidores y minoristas durante un brote (en inglés)
- A quién contactar
- Seguridad de las fórmulas infantiles del USDA FNS (WIC) (en inglés)
- Números gratuitos de las agencias estatales de WIC
- Mapa de contactos del USDA (en inglés)
Los siguientes productos están incluidos en el retiro si tienen los tres elementos a continuación:
-
los dos primeros dígitos del código son del 22 al 37, y
-
el código en el contenedor contiene K8, SH o Z2, y
-
la fecha de vencimiento es 4-1-2022 (ABR 2022) o posterior
Productos de Similac
Abbott Similac 360 Total Care Infant Formula with Iron
Abbott Similac Advance
Abbott Similac Advance Step-1
Abbott Similac Advance Step-2
Abbott Similac Advance Infant Formula with Iron
Abbott Similac Human Milk Fortifier
Abbott Similac Organic
Abbott Similac Organic with A2 Milk Infant Formula with Iron
Abbott Similac Organic with A2 Milk Toddler Drink
Abbott Similac Organic Toddler with A2 Milk Infant Formula with Iron
Abbott Similac Pro-Advance
Abbott Similac Pro-Advance Infant Formula with Iron
Abbott Similac Pro-Sensitive Infant Formula with Iron
Abbott Similac Pro-Total Comfort Infant Formula with Iron
Abbott Similac Sensitive
Abbott Similac Sensitive Infant Formula with Iron
Abbott Similac Sensitive Lactose Sensitivity
Abbott Similac for Supplementation
Abbott Similac For Spit Up Infant Formula with Iron
Abbott Similac Total Comfort
Abbott Similac Total Comfort Infant Formula with Iron
Abbott Similac EleCare HMO
Abbott Similac EleCare
Abbott EleCare Similac Gold
Abbott EleCare Similac
Abbott Similac PM 60/40 - only lot code 27032K80 (can) / 27032K800 (case)
Productos de Alimentum
Abbott Infant Formula Powder
Abbott Similac Alimentum
Abbott Similac Alimentum Allergies & Colic Hypoallergenic Infant Formula
Abbott Similac Alimentum with 2'-FL HMO
Abbott Similac Alimentum Eye Q Plus
Abbott Similac Alimentum HMO
Abbott Alimentum HMO
Abbott Similac Alimentum infant formula
Abbott Similac Alimentum Infant Formula with Iron
Abbott Similac Alimentum Toddler Drink
Productos de EleCare
Abbott EleCare
Abbott EleCare Amino Acid-Based Powder Infant Formula with Iron
Abbott EleCare Infant Formula Unflavoured
Abbott EleCare Junior Vanilla
Abbott EleCare Jr Similac Vanilla
Abbott EleCare Jr Amino Acid-Based Nutrition Powder Unflavored
Abbott EleCare Jr Amino Acid-Based Nutrition Powder Banana
Abbott EleCare Jr Amino Acid-Based Nutrition Powder Chocolate
Abbott EleCare Similac
Abbott EleCare Similac Gold
Abbott Similac EleCare HMO
Abbott Similac EleCare
EleCare LCP Hypoallergenic
Información adicional para padres y cuidadores de bebés que reciben fórmulas médicas especiales para bebés y personas que usan ciertos alimentos médicos
La instalación de Abbott Nutrition que produce fórmulas infantiles retiradas del mercado también produce fórmulas infantiles metabólicas y de otras especialidades médicas para bebés con defectos congénitos del metabolismo y otras necesidades médicas, así como alimentos médicos. Estos productos, con la excepción de un lote de Abbott Similac PM 60/40, no han sido retirados porque la FDA ha determinado que el riesgo de no tener disponibles estos productos especiales podría empeorar significativamente las condiciones médicas subyacentes. Para muchos de estos pacientes, el riesgo de eventos adversos potencialmente mortales por el acceso restringido a estos productos de necesidad crítica es probablemente mayor que el riesgo de consumir productos que se han producido en el centro.
La FDA quiere asegurarse de que los padres y cuidadores que usan estos productos especiales estén conscientes de que puede haber algún riesgo de contaminación por Cronobacter. Si es posible, los padres y cuidadores deben consultar con su proveedor médico para evaluar si los productos parecidos pueden ser apropiados. Si los productos alternativos parecidos no están disponibles o no son apropiados, los padres y cuidadores deben tener mucho cuidado al seguir los consejos actualizados de los CDC para padres sobre cómo reducir el riesgo de contaminación de la fórmula con Cronobacter durante la preparación del producto en polvo, ya sea que la contaminación provenga del producto mismo. o de otras fuentes de contaminación en el hogar.
Glutarex-1
Glutarex-2
Cyclinex-1
Cyclinex-2
Hominex-1
Hominex-2
I-Valex-1
I-Valex-2
Ketonex-1
Ketonex-2
Phenex-1
Phenex-2
Phenex-2 Vanilla
Pro-Phree
Propimex-1
Propimex-2
ProViMin
Calcilo XD
Tyrex-1
Tyrex-2
Similac PM 60/40
Es importante tener en cuenta que estas fórmulas especiales para bebés y alimentos médicos no se venden en las tiendas minoristas tradicionales. Estos productos a menudo requieren receta médica y se venden a través de farmacias especializadas y otros canales de distribución especializados, como proveedores de productos médicos.
Los padres y cuidadores de bebés y niños que usan estos productos deben comunicarse con los proveedores de atención médica de sus hijos si tienen preguntas sobre el uso de estos productos.
Distribución internacional de productos
El retiro del mercado afecta a Alimentum, EleCare y Human Milk Fortifier para los mercados fuera de los EE. UU. Ningún otro producto de Abbott Nutrition distribuido fuera de los EE. UU. está afectado por este retiro. Según la compañía, los productos retirados se distribuyeron en los siguientes países/localidades: Australia, Baréin, Barbados, Bermudas, Canadá, Chile, China, Colombia, Costa Rica, República Dominicana, Ecuador, Egipto, Guam, Guatemala, Hong Kong, India, Indonesia, Israel, Jordania, Kuwait, Líbano, Malasia, México, Nueva Zelanda, Omán, Perú, Puerto Rico, Qatar, Arabia Saudí, Singapur, Sudáfrica, Sudán, Taiwán, Tailandia, Emiratos Árabes Unidos, Reino Unido y Vietnam ANI Sur.
Para obtener información adicional, los funcionarios y clientes internacionales pueden visitar la página de retiros de la compañía para obtener información de contacto.
Vigilancia de Cronobacter
La vigilancia de la infección por Cronobacter no se maneja de la misma manera que la infección por patógenos alimentarios más comunes, como Salmonella o E. coli O157:H7. Cronobacter no es notificable a nivel nacional (en inglés), excepto en un estado, lo que significa que los médicos y los laboratorios no están obligados a informar de los casos a su departamento de salud. Dado que Cronobacter no es un patógeno de declaración obligatoria a nivel nacional, la FDA confía en las quejas de los consumidores enviadas a la Agencia y en los proveedores de atención médica que informan directamente a la FDA sobre los bebés con infecciones por Cronobacter. Además, como Cronobacter no es un patógeno de declaración obligatoria a nivel nacional, rara vez se realiza la secuenciación del genoma completo (WGS, por sus siglas en inglés) de estos aislamientos. Hasta la fecha, no se ha detectado ningún brote de Cronobacter utilizando WGS.
Cuando se notifican casos aislados de Cronobacter, la FDA lleva a cabo una revisión exhaustiva de cada queja, realiza un muestreo de los productos e inicia inspecciones según corresponda. La FDA colabora con los CDC, que han elaborado un cuestionario detallado específico para las infecciones por Cronobacter que suelen utilizar los departamentos de salud estatales en los casos de infección por Cronobacter sakazakii.
Actualizaciones anteriores
9 de marzo de 2022
La enfermedad por Salmonella Newport incluida anteriormente como parte de esta investigación de reportes y enfermedades fue elimina. En las primeras etapas de esta investigación, la FDA incluyó todas las quejas de los consumidores sobre enfermedades con exposición a productos de las instalaciones de Sturgis, MI. Después de una investigación más profunda, la FDA ha determinado que no hay suficiente información para vincular definitivamente esta enfermedad con la fórmula infantil en polvo. Los CDC confirmaron que que esta enfermedad única de Salmonella no está vinculada a un brote. La FDA y los CDC continúan monitoreando los casos de Salmonella y las quejas de los consumidores que pueden estar relacionadas con este incidente.
28 de febrero de 2022
A partir del 28 de febrero, los CDC han anunciado una enfermedad adicional de Cronobacter sakazakii con exposición a fórmula infantil en polvo producida en las instalaciones de Abbott Nutrition en Sturgis, MI. La infección por Cronobacter puede haber sido una causa contribuyente de la muerte de este paciente. En total, esta investigación incluye cuatro reportes de infecciones por Cronobacter sakazakii en bebés (tres de denuncias de la FDA y un caso de los CDC) y una denuncia de infección por Salmonella Newport en un lactante. Las cinco enfermedades (cuatro infecciones por Cronobacter y una infección por Salmonella Newport) resultaron en hospitalización y Cronobacter pudo haber contribuido a la muerte de dos pacientes.
Se informó que el paciente más reciente consumió el producto Similac PM 60/40 de Abbott Nutrition con el código de lote 27032K800 antes de la infección por Cronobacter sakazakii. La FDA y los CDC informaron a la empresa de estos hallazgos y el 28 de febrero de 2022, Abbott Nutrition retiró voluntariamente la fórmula infantil en polvo Similac PM 60/40 con el código de lote 27032K800. Esta es una fórmula especial para ciertos bebés que se beneficiarían de una menor ingesta de minerales y no se incluyó en el retiro anterior. En este momento, Similac PM 60/40 con código de lote 27032K80 (lata) / 27032K800 (envase) son el único tipo y lotes de esta fórmula especial que se están retirando.
Este lote particular de Similac PM 60/40 se distribuyó a EE. UU. e Israel. Si su fórmula regular no está disponible, comuníquese con el proveedor de atención médica de su hijo para obtener recomendaciones sobre cómo cambiar las prácticas de alimentación.
Entendemos que la fórmula infantil es la única fuente de nutrición para muchos bebés y es un producto esencial. La FDA está trabajando con Abbott Nutrition para evaluar mejor los impactos del retiro y comprender la capacidad de producción en otras instalaciones de Abbott que producen algunas de las marcas afectadas. También estamos trabajando con Abbott Nutrition en la reanudación segura de la producción en las instalaciones de Sturgis, MI. La FDA continúa investigando y actualizará este aviso en caso de que se disponga de información adicional sobre la seguridad del consumidor.
25 de febrero de 2022
Como resultado de la investigación en curso, Abbott Nutrition ha retirado ciertos productos de fórmula infantil en polvo y la FDA está aconsejando a los consumidores que no usen las fórmulas infantiles en polvo Similac, Alimentum, o EleCare retiradas del mercado y producidas en la instalación en Sturgis, MI.
Reconocemos que el retiro de Abbott Nutrition (en inglés) dio lugar a que los consumidores buscaran marcas o tipos alternativos de fórmula infantil y que el retiro ha creado nuevas preocupaciones sobre la disponibilidad de ciertos tipos de fórmula infantil, particularmente dada la tensión general en las cadenas de suministro experimentada durante la pandemia del COVID-19.
Entendemos que las fórmulas infantiles son la única fuente de nutrición para muchos bebés y son un producto esencial.
La FDA está trabajando con Abbott Nutrition para evaluar mejor los impactos del retiro y entender la capacidad de producción en otras instalaciones de Abbott que producen algunas de las marcas afectadas. También estamos trabajando con Abbott Nutrition en la reanudación segura de la producción en las instalaciones en Sturgis, MI. A lo largo de la pandemia, la FDA también ha estado monitoreando los riesgos potenciales de esta categoría de productos en la cadena de suministro y ha estado en contacto con los fabricantes de fórmula infantil y sus grupos comerciales. En el momento en que Abbott Nutrition inició el retiro, la FDA intensificó la comunicación con los fabricantes de fórmulas infantiles para preguntar sobre su capacidad y el impacto potencial de esta situación en desarrollo. Continuaremos las conversaciones con Abbott Nutrition y otros fabricantes de fórmulas infantiles y consideraremos todas las herramientas disponibles para apoyar el suministro de productos de fórmula infantil.
También estamos colaborando con el Servicio de Alimentación y Nutrición (FNS, por sus siglas en inglés) del Departamento de Agricultura de los Estados Unidos para monitorear el impacto del retiro del mercado en el Programa WIC.
20 de febrero de 2022
El 2/17/2022, Abbott Nutrition inició un retiro voluntario (en inglés) de ciertas fórmulas infantiles en polvo. Los productos fabricados en la instalación en Sturgis se pueden encontrar en todo Estados Unidos y es probable que se hayan exportado también a otros países o lugares. Las autoridades de salud canadienses también han emitido una advertencia de retiro (en inglés).
17 de febrero de 2022
La FDA, junto con los CDC y los socios estatales y locales están investigando cuatro quejas de consumidores sobre enfermedades infantiles relacionadas con productos de la instalación de Abbott Nutrition en Sturgis, MI, recibidas entre el 9/6/2021 y el 12/18/2021. Todos los casos se reportan como consumo de fórmula infantil en polvo (IF) producida en la instalación de Abbott Nutrition en Sturgis, MI. Estas quejas incluyen tres informes de infecciones por Cronobacter sakazakii y un informe de infección por Salmonella Newport en bebés. Los cuatro casos relacionados con estas quejas fueron hospitalizados y Cronobacter puede haber contribuido a una muerte en uno de los casos.
La FDA ha iniciado una inspección de la instalación. Los hallazgos hasta la fecha incluyen varios resultados positivos de Cronobacter en muestras ambientales tomadas por la FDA, y observaciones adversas en la inspección por parte de los investigadores de la FDA. Una revisión de los registros internos de la compañía también indica contaminación ambiental con Cronobacter sakazakii y la destrucción de productos por parte de la compañía debido a la presencia de Cronobacter.
La FDA emite este aviso para advertir a los consumidores que eviten la compra o el uso de ciertas fórmulas infantiles en polvo producidas en la instalación en Sturgis, MI.
Esta es una investigación en curso y la compañía está trabajando con la FDA para iniciar un retiro voluntario del producto potencialmente afectado. La FDA sigue investigando y actualizará este aviso si se dispone de más información sobre la seguridad de los consumidores.